Hukum-hukum Dasar Kimia
Hukum Kekekalan Massa ( Hukum Lavoisier ).
Lavoisier menyimpulkan bahwa : jika suatu reaksi kimia dilakukan di ruang tertutup sehingga tidak ada zat-zat yang hilang, maka
Massa zat-zat sebelum reaksi dan sesudah reaksi tidak berkurang atau tidak bertambah (tetap).
Dalam tabung tertutup ditimbang 32 gram belerang dan 63,5 gram tembaga. Setelah dicampur lalu dipanaskan dalam tabung tertutup dan reaksi berjalansempurna maka terjadi zat baru, yaitu tembaga ( II ) sulfida. Berapa massa zat baru tersebut ?
Jawab :
Ternyata massa zat baru tersebut sama dengan massa total zat-zat sebelum reaksi.
Bunyi Hukum Kekekalan Massa :” JUMLAH MASSA ZAT-ZAT SEBELUM DAN SESUDAH REAKSI ADALAH SAMA ”
HUKUM PERBANDINGAN TETAP ( HUKUM PROUST )
Bunyi Hukum Perbandingan Tetap :
” DALAM SUATU SENYAWA, PERBANDINGAN MASSA UNSUR-UNSUR PENYUSUNNYA SELALU TETAP ”
Pada percobaan 1 gram hidrogen dicampur dengan 8 gram oksigen hasilnya ialah 9 gram air. Dan ternyata 8 gram oksigen hanya dapat bereaksi dengan 1 gram hidrogen saja.
Data Percobaan Hidrogen dan Oksigen
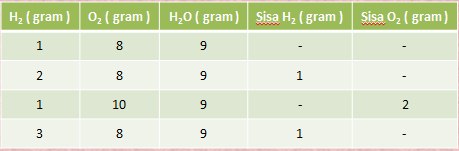
Contoh soal :
Jika kita mereaksikan 4 gram hidrogen dengan 40 gram oksigen, berapa gram air yang terbentuk?
jawab :

HUKUM PERBANDINGAN BERGANDA ( HUKUM DALTON )
” Bila unsur-unsur dapat membentuk dua macam senyawa atau lebih, dimana massa salah satu unsur tersebut tetap (sama), maka perbandingan massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan bulat dan sederhana ”
Contoh :
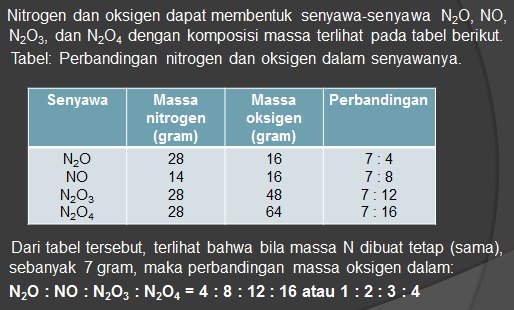
HUKUM PERBANDINGAN VOLUME ( HUKUM GAY LUSSAC )
” Pada temperatur dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi dan volume gas hasil reaksi merupakan perbandingan bilangan bulat dan sederhana “

Pada reaksi zat yang wujudnya gas, perbandingan koefisien reaksi ekuivalen dengan perbandingan volume jika reaksi tersebut
Dilakukan pada temperatur dan tekanan yang sama.

Jawab :

HIPOTESIS AVOGADRO
” gas-gas yang volumenya sama, jika diukur pada temperatur dan tekanan yang sama, mengandung jumlah molekul yang sama pula ”
Avogadro menjelaskan percobaan Gay Lussac dengan menganggap partikel – partikel gas tidak sebagai atom-atom, tetapi sebagai molekul-molekul

Perbandingan volume gas-gas yang bereaksi dan gas-gas hasil reaksi jika diukur pada temperatur dan tekanan yang sama akan sesuai dengan perbandingan jumlah molekulnya, akan sama dengan perbandingan koefisien reaksinya.
Contoh Soal :
Gas hidrogen direaksikan dengan gas oksigen membentuk 8 liter ( T,P ) uap air. berapa liter gas hidrogen dan gas oksigen dibutuhkan pada reaksi tersebut ?

Sekian ulasan saya mengenai hukum-hukum dasar kimia dan bunyinya. Semoga bermanfaat.

Tidak ada komentar:
Posting Komentar